1. Các khái niệm về cân bằng hóa học
Cân bằng hóa học là một trong những khái niệm quan trọng trong hóa học, giúp chúng ta hiểu rõ hơn về các phản ứng hóa học diễn ra trong tự nhiên cũng như trong các quá trình công nghiệp. Để có cái nhìn tổng quát hơn về cân bằng hóa học, chúng ta cần tìm hiểu các khái niệm căn bản, bao gồm phản ứng hóa học, phản ứng một chiều và phản ứng thuận nghịch.Khái niệm phản ứng hóa học: Là quá trình biến đổi các chất đầu thành sản phẩm. Tuy nhiên, có nhiều phản ứng, các chất sản phẩm sinh ra lại có thể phản ứng với nhau tạo thành các chất ban đầu.

1.1 Phản ứng một chiều
Xét một phản ứng đốt cháy khí methane trong khí oxygen:
CH4 + 2O2 CO2 + 2H2O
Khi đốt cháy khí methane, sẽ thu được sản phẩm bao gồm khí carbon dioxide và hơi nước. Trong điều kiện này, các chất sản phẩm không phản ứng được với nhau để tạo thành chất ban đầu. Phản ứng có chiều phản ứng như trên được gọi là phản ứng một chiều.
Phương trình hoá học của phản ứng một chiều sẽ được biểu diễn bằng một mũi tên một chiều chỉ chiều phản ứng.
Ví dụ: NaOH + HCl → NaCl + H₂O
1.2 Phản ứng thuận nghịch
Hai thí nghiệm sau đều được thực hiện ở cùng một điều kiện (bình kín dung tích 10L, nhiệt độ 445°C):
Thí nghiệm 1: Cho 1 mol H2 và 1 mol I2, vào bình kín. Kết quả thí nghiệm đã cho thấy dù thời gian phản ứng có kéo dài bao lâu thì trong bình vẫn sẽ chỉ tạo ra 1,6 mol HI; còn dư 0,2 mol H2 và 0,2 mol I2.
Thí nghiệm 2: Cho 2 mol HI vào bình kín. Kết quả thí nghiệm cũng cho thấy dù thời gian của phản ứng kéo dài trong bao lâu thì trong bình cũng vẫn chỉ tạo ra 0,2 mol H2 và 0,2 mol I2 và còn dư 1,6 mol HI.
Thực hiện những yêu cầu sau:
- a) Viết phương trình hoá học của các phản ứng đã xảy ra trong thí nghiệm 1 và thí nghiệm 2
- b) Trong cả hai thí nghiệm ở trên, cho dù thời gian của phản ứng kéo dài thêm bao lâu thì các chất ban đầu đều sẽ còn lại sau khi phản ứng. Giải thích.
Ở nhiệt độ 445 °C, trong bình chứa hỗn hợp H2 và I2, xảy ra đồng thời hai phản ứng:
H2 (g) + I2 (g) → 2HI (g) (1)
2HI (g) → H2 (g) + I2 (g) (2)
Ở thí nghiệm 1, khi H2 tác dụng với I2, tạo thành HI, đồng thời HI lại phân huỷ để tạo thành I2 và H2 nên dù thời gian kéo dài bao lâu, phản ứng vẫn không thể xảy ra hoàn toàn.
Phản ứng giữa H2 và I2, trong điều kiện trên được gọi là loại phản ứng thuận nghịch và được biểu diễn bằng phương trình hoá học sau:
H2(g) + I2(g) ⇌ 2HI(g)
Tương tự, ở thí nghiệm 2 cũng đã xảy ra phản ứng thuận nghịch:
2HI(g) ⇌ H2(g) + I2(g)
Phản ứng thuận nghịch được định nghĩa là phản ứng xảy ra theo hai chiều ngược nhau ở trong cùng một điều kiện.
Phương trình hoá học của phản ứng thuận nghịch sẽ được biểu diễn bằng dấu hai nửa mũi tên ngược chiều nhau. Chiều phản ứng từ trái sang phải là chiều phản ứng thuận, còn chiều phản ứng từ phải sang trái sẽ là chiều phản ứng nghịch.
Trong thực tế, các phản ứng thuận nghịch thường xảy ra không hoàn toàn bởi vì khi ở trong cùng một điều kiện, các chất sẽ phản ứng tác dụng với nhau để tạo thành các chất sản phẩm sau phản ứng (phản ứng thuận) đồng thời các chất sản phẩm lại tác dụng cùng với nhau để tạo thành được những chất ban đầu (phản ứng nghịch).

1.3 Trạng thái cân bằng
Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g)
Số liệu về sự thay đổi số mol các chất trong bình phản ứng ở thí nghiệm 1 được trình bày trong bảng dưới đây:
Bảng số mol của các chất có trong bình phản ứng trong thí nghiệm 1 thay đổi theo đơn vị thời gian
| Thời gian (s) | Số mol H2 | Số mol I2 | Số mol HI |
|---|---|---|---|
| 0 | 1.0 | 1.0 | 0 |
| t1 | 0.6 | 0.6 | 0.8 |
| t2 | 0.4 | 0.4 | 1.2 |
| t3 | 0.3 | 0.3 | 1.4 |
| t4 | 0.2 | 0.2 | 1.6 |
| t5 ... t∞ | 0.2 | 0.2 | 1.6 |
Thực hiện các yêu cầu:
- a) Hãy vẽ đồ thị biểu diễn được sự thay đổi về số mol của các chất theo đơn vị thời gian
- b) Từ đồ thị, hãy đưa ra những nhận xét về sự thay đổi về số mol của các chất theo khoảng thời gian.
- c) Viết ra biểu thức về định luật tác dụng khối lượng đối với phản ứng thuận và phản ứng nghịch, từ đó hãy dự đoán về những sự thay đổi tốc độ trong mỗi phản ứng theo đơn vị thời gian (biết rằng các phản ứng này đều là những phản ứng đơn giản)
- d) Bắt đầu từ thời điểm t nào thì số mol của các chất ở trong hệ phản ứng sẽ không bị thay đổi nữa?
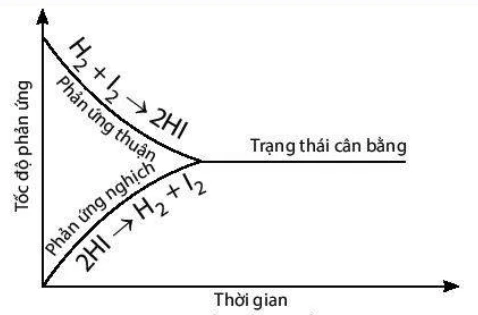
Trong thí nghiệm trên, lúc đầu phản ứng thuận có tốc độ lớn hơn phản ứng nghịch và ưu tiên tạo ra hydrogen iodide. Theo thời gian, tốc độ phản ứng thuận giảm dần, tốc độ phản ứng nghịch tăng dần đến khi tốc độ hai phản ứng bằng nhau. Tại thời điểm này, số mol của các chất hydrogen, iodine, hydrogen iodide sẽ không thay đổi nữa. Đây chính là thời điểm để phản ứng thuận nghịch đạt được tới trạng thái cân bằng.
Khái niệm: Trạng thái cân bằng của một phản ứng thuận nghịch chính là trạng thái mà tại đó tốc độ của phản ứng thuận bằng với tốc độ phản ứng nghịch.
Cân bằng hoá học là một cân bằng động, các chất tham gia sẽ xảy ra phản ứng liên tục với nhau để tạo thành các chất sản phẩm và những chất sản phẩm cũng lại liên tục phản ứng với nhau để tạo thành được những chất ban đầu nhưng với một tốc độ bằng nhau nên ở trạng thái cân bằng, nồng độ các chất sẽ không bị thay đổi.
2. Ý nghĩa biểu thức hằng số cân bằng
2.1 Biểu thức hằng số cân bằng
Xét phản ứng thuận nghịch: H2(g) + I2(g) ⇌ 2HI(g). Thực hiện phản ứng trên ở trong bình kín, ở nhiệt độ 445 °C với các nồng độ ban đầu khác nhau. Số liệu về nồng độ của các chất ở thời điểm ban đầu và ở trạng thái cân bằng trong các thí nghiệm được trình bày trong bảng dưới đây.
Bảng nồng độ các chất của phản ứng H2(g) + I2(g) ⇌ 2HI(g) ở thời điểm ban đầu và ở trạng thái cân bằng:
| Nồng độ các chất ở thời điểm ban đầu (mol/L) | Nồng độ các chất ở trạng thái cân bằng (mol/L) |
|---|---|
| H2 0.1 | H2 0.02000 |
| I2 0.1 | I2 0.02000 |
| HI 0 | HI 0.02000 |
Tính giá trị ở mỗi thí nghiệm và nhận xét kết quả thu được.
được gọi là biểu thức hằng số cân bằng của phản ứng thuận nghịch:
H2(g) + I2(g) ⇌ 2HI(g)
Xét phản ứng thuận nghịch tổng quát: aA + bB ⇌ cC + dD:
Ở trạng thái cân bằng, hằng số cân bằng (KC) của phản ứng sẽ được xác định theo biểu thức dưới đây:
Trong đó: Ký hiệu [A], [B], [C], [D] là biểu thị cho nồng độ mol của các chất A, B, C, D khi ở trạng thái cân bằng; a, b, c, d là biểu thị cho hệ số tỉ lượng của các chất trong phương trình hoá học khi tham gia phản ứng.
Thực nghiệm cho thấy hằng số cân bằng KC của một phản ứng thuận nghịch chỉ phụ thuộc nhiệt độ và bản chất của phản ứng. Đối với những phản ứng khi có chất rắn tham gia, sẽ không biểu diễn nồng độ của chất rắn ở trong biểu thức hằng số cân bằng. Ví dụ:
C(s) + CO2(g) ⇌ 2CO(g)
2.2 Ý nghĩa biểu thức hằng số cân bằng
Hằng số cân bằng KC sẽ phụ thuộc vào bản chất của phản ứng và nhiệt độ của phản ứng.
Biểu thức xác định hằng số cân bằng cho thấy: KC càng lớn thì phản ứng thuận càng chiếm ưu thế hơn và ngược lại, KC càng nhỏ thì phản ứng nghịch càng chiếm ưu thế hơn.
3. Các yếu tố ảnh hưởng đến cân bằng hóa học
3.1 Yếu tố nhiệt độ
Yếu tố nhiệt độ đóng vai trò quan trọng trong sự chuyển dịch cân bằng của phản ứng hóa học. Thí nghiệm dưới đây sẽ minh họa điều này:
2NO2(g) ⇌ N2O4(g)
(màu nâu đỏ) (không màu)
Chuẩn bị: 3 ống nghiệm thủy tinh chứa khí NO2, nút kín bịt ống nghiệm có màu giống nhau, cốc nước đá và cốc nước nóng.
Tiến hành:
- - Ống nghiệm (1) để so sánh.
- - Ngâm ống nghiệm thứ (2) vào trong cốc nước đá trong khoảng thời gian 1 - 2 phút.
- - Ngâm ống nghiệm thứ (3) vào trong cốc nước nóng trong khoảng thời gian 1 - 2 phút.
Yếu tố nhiệt độ cũng ảnh hưởng đến sự chuyển dịch cân bằng của phản ứng khác:
CH3COONa + H2O ⇌ CH3COOH + NaOH
Chuẩn bị: dung